Ejemplo de estructura de Lewis (Br. 2) Br Br . de electrones compartidos Par de electrones solitarios. De esta manera podemos ver que cada átomo de Br comparte uno de los 7 electrones de su capa de valencia con el otro átomo y así cada uno consigue el octeto. Grupo Electrones de valencia 1 1 2 2 13 3 14 4 15 5 16 6 17 7 18 (Excepto He) 8 2 Ejercicios de diagrama de Lewis y geometría molecular (TRePEV) Para las siguientes moléculas/iones dibujar el diagrama de Lewis e indicar la geometría y polaridad de las mismas haciendo uso de la "Teoría de repulsión de pares de electrones de la capa de valencia" (TRePEV): HF (H: Z=1, F: Z=9). b) HCN (C: Z=6, N: Z=7, H: Z=1).

Ejercicios resueltos estructuras de Lewis Física Química
Estructura de Lewis ejercicios ejemplos resueltos , explicación paso a paso tutorial física y química ,3 ESO 4 ESO 1º 2º Bachillerato universidad . H20 , NH3 ,CH4 SO2 ,03 , HCN , Problemas con solución en vídeo , desde cero hasta llegar a ser una máquina . Ejercicio: Representa la estructura de Lewis del O 2: Empezaremos con lo mas sencillo de menor a mayor. Estructura de Lewis del O 2: Paso 1: Escribe el simbolo atomico de los elementos de forma simetrica y con el elemento mas electronegativo en el Centro. Simétricamente significa que si das vuelta el orden se ve igual. c) Cita una propiedad de cada uno de los compuestos del apartado anterior. 3. Escribe la estructura de Lewis para las moléculas SiCl 4 y PCl 3. 4. Considerando las sustancias Br 2, Fe, HF y NaBr, justifique en función de sus enlaces: a) Si son o no solubles en agua. b) Si conducen la corriente eléctrica a temperatura ambiente. 5. El último electrón del átomo X tiene los números cuánticos: n = 3, l =1, m = -1 y s =. -1⁄2; si el átomo X forma los iones HXO - y XO 2-, determine: 3 4. ¿cuál es el elemento X. Las estructuras de Lewis de los iones (con cargas formales) La diferencia entre la geometría molecular de los iones. Azufre.
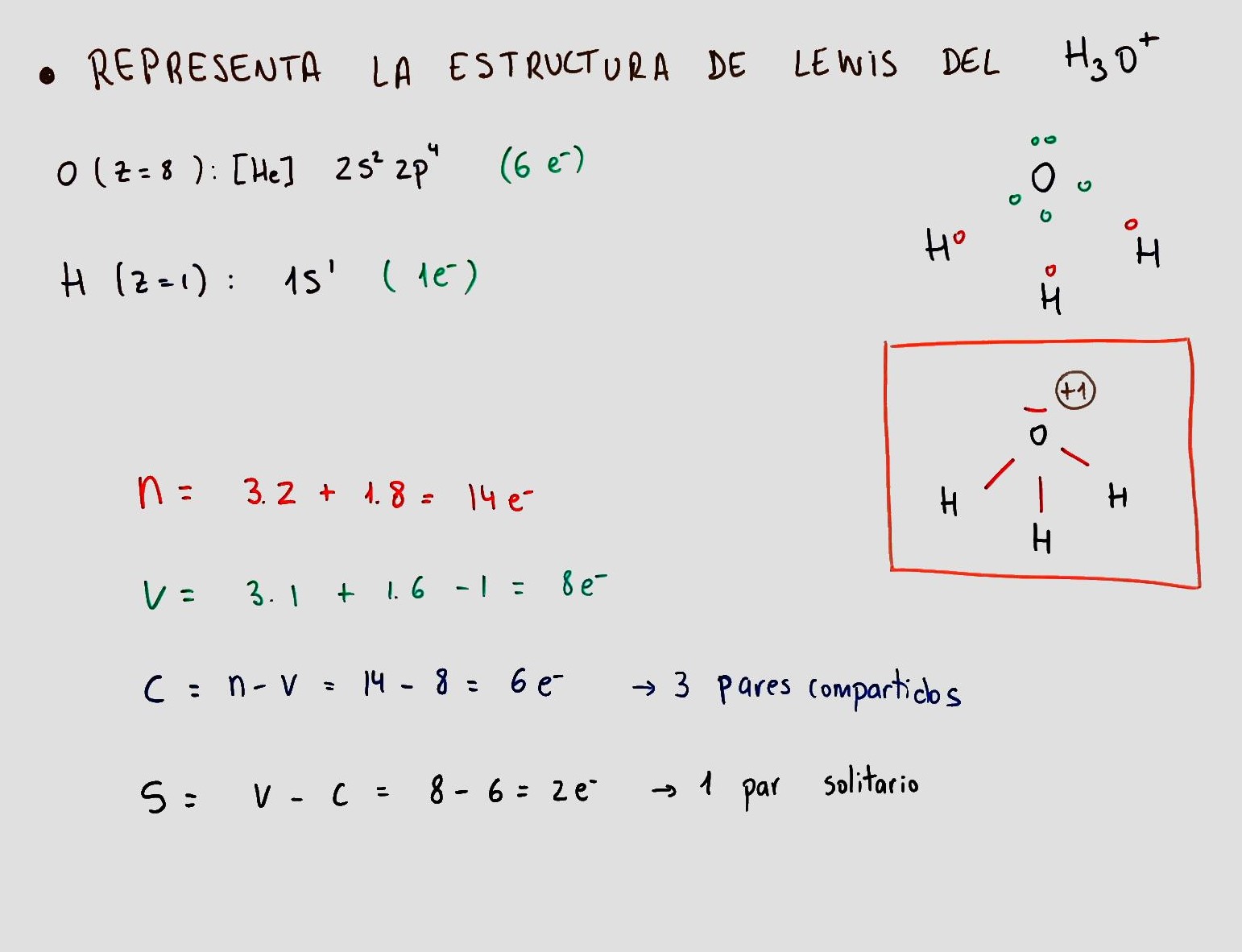
Ejercicios resueltos de estructura Lewis iones Física Química
Escriba los símbolos de Lewis de los iones en cada uno de los siguientes compuestos iónicos y los símbolos de Lewis del átomo del cual se forman: MgS; Al 2 O 3; GaCl 3; K 2 O; Li 3 N; KF (a); (b); (c); (d); (e); (f) En las estructuras de Lewis enumeradas aquí, M y X representan varios elementos en el tercer período de la tabla periódica. NaClO4. HNO3. Una estructura de Lewis no es más que un modelo con el cual se pretende ilustrar la distribución más plausible o probable de los electrones de valencia. Las estructuras de Lewis se generan con la idea de conseguir que todos los átomos involucrados cumplan la regla del octeto, (donde todos los átomos involucrados tengan al. Un símbolo de Lewis consiste en un símbolo elemental rodeado de un punto por cada uno de sus electrones de valencia: La Figura 7.9 muestra los símbolos de Lewis para los elementos del tercer periodo de la tabla periódica. Figura 7.9 Símbolos de Lewis que ilustran el número de electrones de valencia de cada elemento del tercer periodo de. CF = N° e - de valencia - N° e - no compartidos - ½ N° e - no compartidos. Por ejemplo para cada átomo de O en CO 2: CF = 6 - 4 - 2 = 0. La estructura de Lewis mas probable es aquella para la cual: El valor de la CF sea más próximo a cero. Si existe CF, la CF negativa esté localizada sobre el átomo más electronegativo.

Ejercicios resueltos estructuras de Lewis Física Química
Es útil ver qué se puede trasmitir a través de modelos 3D, geometría molecular por ejemplo, y lo que se transporta por los modelos de estructura de Lewis, un ejemplo es la asignación de electrones alrededor de átomos y la asignación de electrones para la unión. Una aclaración importante, es que los twirlymols muestran conexiones, no. Ejercicio 1 : Estructura de Lewis del ácido nitroso SCl 2 Ejercicio 2 : Estructura de Lewis del ácido nitroso HNO 2 Eje. Ejercicios resueltos hibridación Ejercicio 1 : Justifica, usando la teoría de hibridación de orbitales atómicos, la geometría molecular tetraédrica del metano CH 4 - 1 e.
Ejemplos: Aquí tomaremos la molécula de CO 2 como ejemplo para explicar el procedimiento paso a paso:. 1. Número total de electrones de valencia: 4 (átomo de C) + 2×6 (2 átomos de O) = 16. Siempre DOBLE COMPROBACIÓN: En la estructura correcta de Lewis, el número total de electrones involucrados (unión más electrones no enlazantes) debe ser igual a este número, ¡menos o más son. ¡Buenos días Amigos de la Química!Libro con más ejercicios en www.amigosdelaquimica.esBienvenidos a este vídeo en el que vamos a ver las estructuras de Lewis.

Ejercicios resueltos de estructura Lewis iones Física Química
Aprende gratuitamente sobre matemáticas, arte, programación, economía, física, química, biología, medicina, finanzas, historia y más. Khan Academy es una organización sin fines de lucro, con la misión de proveer una educación gratuita de clase mundial, para cualquier persona en cualquier lugar. El ácido perclórico (HClO4) es un ácido fuerte, por lo que en disolución acuosa se disocia totalmente y hay que tener precauciones a la hora de manejarlo. A concentraciones superiores al 72% es inestable y puede resultar explosivo. Represente las posibles estructuras Lewis resonantes de la molécula indicando la(s) más contribuyente(s).




