FIRLATTI. Fr=FRANSİYUM. 1/A-2/A-3/A grubu elementleri metaldir.Sadece Hidrojen atomu 1/A grubu elementidir,fakat ametaldir. 4/A-5/A-6/A/7/A grubu elementleri ametaldir. 8/A grubu soygazdır (asalgazdır),elementlerinin son yörüngesinde 8e vardır.Sadece Helyumun yörüngesinde 2 elektron vardır,fakat soygaz özelliktedir. Elementlerin isimlerini, elektron sayılarını, oksitlenme durumlarını, eğilimlerini, orbital dizilişlerini, isotoplarını gösteren ve arama imkanı sunan dinamik tasarımlı interaktif Web 2.0 periyodik tablo. Bütün tanımları içermektedir.
8.Sınıf 4.Ünite Periyodik Sistem Konu Özeti FENOZOM
Anlatımda kullanılan sunum dosyası : https://www.fenkampus.com/sunum-dosyalari-8-4-1-periyodik-sistem-2/Tüm içerikler:https://www.fenkampus.com/8-4-1-periyod. Bu olgu "periyodik yasa" ve "periyodik sistem" olarak da isimlendiriliyor. Mendeleyev, 1869'da yayımladığı periyodik tablonun ilk versiyonunda bilinen 63 elementi artan atom kütlelerine göre dikey olarak sıralamıştı. ---ÖNEMLİ VİDEO HIZINI 1.25 YAPMANIZI ÖNERİRİM--periyodik tablo özelliklerini anlatan aşırı pratik bir yöntem (ametalik aktiflik, metalik aktiflik, atom çapı. Periyodik sistemde elementler, sol üst köşeye hidrojenin yazılması ve diğer elementlerin de atom numarası artışına göre yazılması ile sıralanmıştır. Atom numarası artışına göre yapılan sıralamada benzer özellik gösteren elementler alt alta getirilmiş ve gruplar oluşturulmuştur. Elementlerin periyodik sistemdeki sıralanmasında ortak bazı genel özellikler.
8.Sınıf 4.Ünite Periyodik Sistem Konu Özeti FENOZOM
Periyodik tablo, kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur. Dilimizde periyodik tablo, periyodik cetvel, periyodik çizelge, elementler tablosu gibi birçok şekilde isimlendirilmiştir.. sonraki üç periyodu ise onyedişer element içeren bir periyodik sistem hazırlamıştır. Mendeleyev'in. Periyodik tablo elementlerin atom numaralarını sıralamaya ek olarak, aynı zamanda bir elementin bağıl atom kütlesini (elementin doğada bulunan izotoplarının ortalama kütlesini) de gösterir. Mesela hidrojeni ele alalım: Sembolü ( H ), elementin adı, atom numarası (1) ve bağıl atom kütlesi (1,01) olarak periyodik tablonun sol üst köşesinde yer alır. 8. Sınıf Fen Bilimleri konusundaki Periyodik Tablo: Elementlerin Sınıflandırılması başlıklı ders videosuna buradan ulaşabilirsiniz. | Khan Academy Türkçe 8. Sınıf Fen Bilimleri 8.4.1. Periyodik Sistem Detaylı & Kodlamalı Konu Anlatımı - DersLig. DERSLERİNE. ÇALIŞMAYA BAŞLA!

3. Periyodik Sistem TYTAYT Kimya
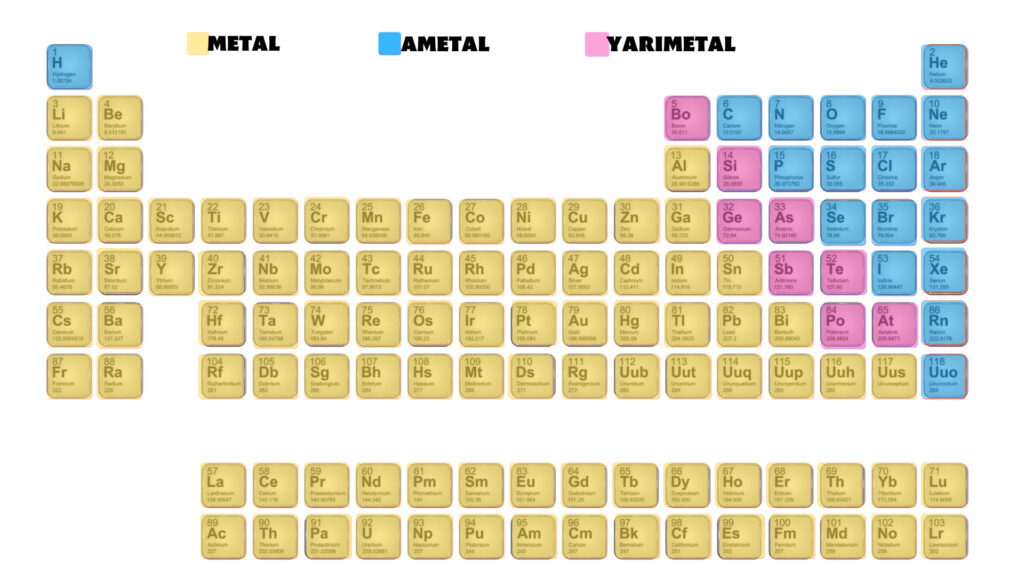
Periyodik tablonun 13. ve 16. grupları arasında sol üstten sağ alta doğru zikzak şeklinde bir çizgi metaller ile ametalleri ayırır. Bu çizgi üzerindeki bazı elementler yarı metal olarak isimlendirilir. Yarı metaller metaloid olarak da bilinir. Bor, silisyum, germanyum, arsenik, antimon ve tellür bilimsel kaynakların birçoğunda. Periyodik Sistem Kodlama, Gruplar, Elementler, TYT, AYT, Kimya , 9 Kimya, 10 Kimya , Özel Gruplar #kodlama #kimya #periyot #sistem #chemistry #experiments
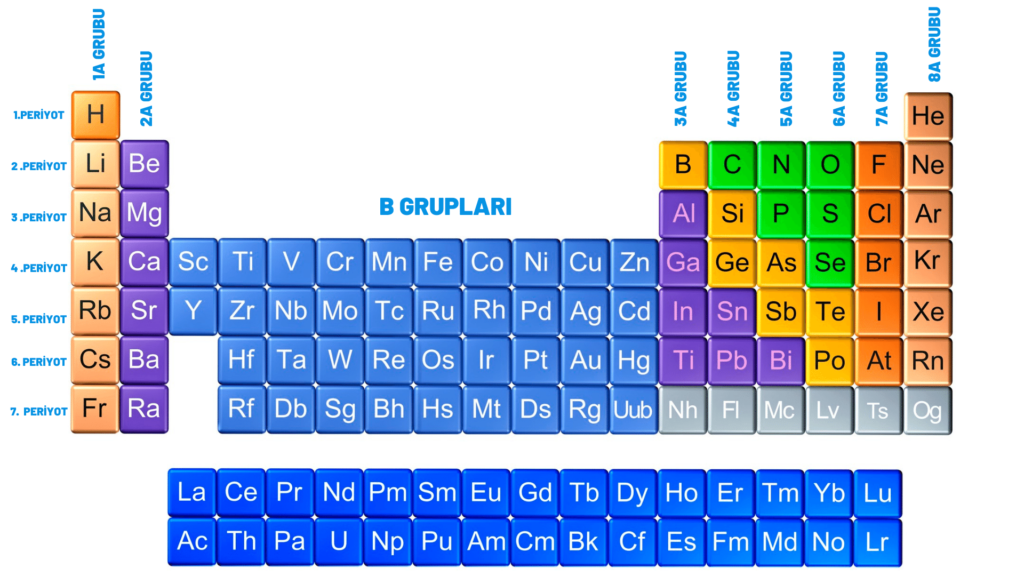
ELEMENTLERİN PERİYODİK TABLOSU Fen Bilimleri Öğretmeni Murtaza YİĞİT 1/A = Alkali Metaller 2/A = Toprak Alkali Metaller 7/A = Halojenler 8/A = Soygazlar B Grupları = Geçiş Metalleri Metaller Ametaller Yarımetaller Soygazlar. Elementlerin fiziksel ve kimyasal özelliklerinin atom kütlesine değil, atom numarasına (proton sayısına) bağlı olduğunu kanıtlamıştır. Periyodik Sistem Elementlerin benzer kimyasal ve fiziksel özelliklerine ve artan atom numaralarına göre gruplandırıldıkları ç izelgeye periyodik tablo / periyodik sistem / periyodik cetvel denir.

bu kırbaç zehir periyodik cetvel ezberleme tekerlemeleri vazgeçme ana toprak Onayla
BU KONUNUN AYRINTILI OLARAK ANLATTIĞIM VİDEOSU : https://www.youtube.com/watch?v=OzT8Yd2DIe8&t=88sDİPÇE : AMETALİK VE METALİK KARAKTER ; AMETALİK VE METALİK. Periyodik cetvel, periyodik çizelge, periyodik sistem, element tablosu gibi pek çok farklı isimle de bilinmektedir. Periyodik tablo grup, periyot ve bloklara göre ayrılmaktadır. Artan atom numaralarına göre sıralanan elementler atom yarıçapı, iyonlaşma enerjisi, elektronegatiflik özelliklerine göre değişiklik göstermektedir.




