Konsep mol kimia dalam Quipper Blog kali ini akan dibahas konsep persamaan reaksi, penyetaraan persamaan reaksi, persentase massa unsur, pengertian mol, massa molar, volume molar, dan contoh soal. Hai Quipperian, bagaimana kabarnya? Semoga selalu sehat dan tetap semangat belajar, ya. Dalam melakukan perhitungan yang berhubungan dengan senyawa kimia atau reaksi, mol adalah konsep yang selalu digunakan. Segala perhitungan kimia ini dilakukan menggunakan prinsip-prinsip tertentu yang telah ditentukan agar tercipta reaksi yang lebih efisien, lho.

Konsep Mol Kimia Kelas 10 • Part 1 Hubungan Mol & Massa, Jumlah
Mol, yang disimbolkan dengan mol, adalah satuan jumlah zat dalam SI. Satu mol mengandung persis 6,02214076 × 1023 entitas elementer. Bilangan tersebut, yang disebut bilangan Avogadro, merupakan nilai numerik tetap dari konstanta Avogadro NA bila dinyatakan dalam satuan mol−1. Konsep mol memberikan ukuran spesifik jumlah atom atau molekul dalam suatu sampel materi yang besar. Satu mol didefinisikan sebagai jumlah zat yang mengandung entitas diskrit yang sama. Definisi Konsep mol adalah Ide atau pengertian mengenai mol, yakni satuan jumlah suatu zat. Jumlah mol dinyatakan dengan simbol n Banyaknya atom atau partikel yang terdapat dalam 12 gram C-12 adalah 6, 02 × 1023 partikel yang disebut dengan tetapan Avogadro yang dinyatakan dengan simbol L atau NA. Konsep Mol dan Tetapan Avogadro Kompas.com - 28/10/2020, 14:56 WIB Silmi Nurul Utami, Rigel Raimarda Tim Redaksi Lihat Foto Bilangan avogadro yang menyatakan banyaknya entitas dalam satu mol. (JONATHAN ATTEBERRY) Sumber BBC, Encyclopaedia Britannica, Chemistry LibreTexts Cari soal sekolah lainnya

Konsep Mol Kimia Kelas 10 • Part 3 Contoh Soal Konsep Mol (2) YouTube
Konsep Rumus Mol by Athirah Muthi Zahrani September 7, 2021 0 Artikel ini akan membahas berbagai konsep rumus mol dengan disertai contoh soal Hola sobat Zenius! Apakah kamu tahu bahwa setiap benda dan zat tersusun oleh partikel-partikel kecil tak kasat mata seperti atom, molekul, atau ion. Modul ini terdiri atas lima kegiatan belajar. Kegiatan belajar 1 membahas. tentang hukum-hukum dasar kimia. Kegiatan belajar 2 membahas tentang unsur dan. persenyawaan. Kegiatan belajar 3 membahas tentang konsep mol dan analisis. konsep mol. Kegiatan belajar 4 membahas tentang persamaan reaksi kimia. Kegiatan. Untuk mengukur sebuah partikel dalam reaksi kimia yang begitu kecil, digunakanlah sebuah konsep mol. Konsep mol di bawah ini akan membahas cara menghitung jumlah partikel (yang dinyatakan dalam 1 mol), masaa molar, hingga volume molar gas. Materi konsep mol. Bagaimana cara menghitung zat-zat yang bereaksi dalam suatu reaksi kimia? Para ahli kimia yang bergabung dalam IUPAC (International Union Pure and Applied Chemistry) sepakat menggunakan satuan yang disebut mol. Satu mol adalah jumlah partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan partikel yang terdapat dalam 12 gram atom C-12.

Kimia Tingkatan 4 KSSM Bab 3 Konsep Mol (Bahagian 1) Konsep Mol
Mol merupakan satuan dasar dalam kimia yang digunakan untuk mengukur jumlah partikel dalam suatu zat, seperti atom, molekul, dan ion. Satuan mol sendiri didefinisikan sebagai jumlah partikel dalam suatu zat yang sama dengan jumlah partikel dalam 12 gram karbon-12 yang murni. Mol (n) adalah satuan pengukuran pada Sistem Satuan Internasional (SI) untuk jumlah zat. Satuan mol didefinisikan sebagai jumlah zat kimia mengandung jumlah partikel representatif, misalnya pada atom, molekul, ion, elektron, ataupun foton. Jumlah mol ini setara dengan jumlah 12 gram karbon-12 ( 12 C). 1. Konsep Mol pada Ar dan Mr
n : jumlah mol. Misalnya kita punya 3 mol besi, berapa ya jumlah atomnya? Yuk kita cari tahu! Jika n = 3, maka. X = 3 × 6,02 × 10²³ (pakai rumus di atas ya) X = 18,02 × 10²³. Jadi, jumlah atom yang ada dalam 3 mol besi adalah 18,02 × 10²³. Nggak cuma itu, mol juga dapat digunakan untuk mencari massa (gram) dari suatu partikel loh. Nih. Konsep Mol Mol adalah satuan dasar SI (Satuan Internasional) yang mengukur jumlah zat. Jika Anda telah mempelajari atom, molekul dan ion sebagai partikel-partikel materi. Bagaimana caranya menghitung jumlah yang sangat banyak dari partikel-partikel materi yang berukuran sangat kecil tersebut? Untuk menyederhanakan jumlah partikel yang sangat kecil ini digunakan istilah MOL.
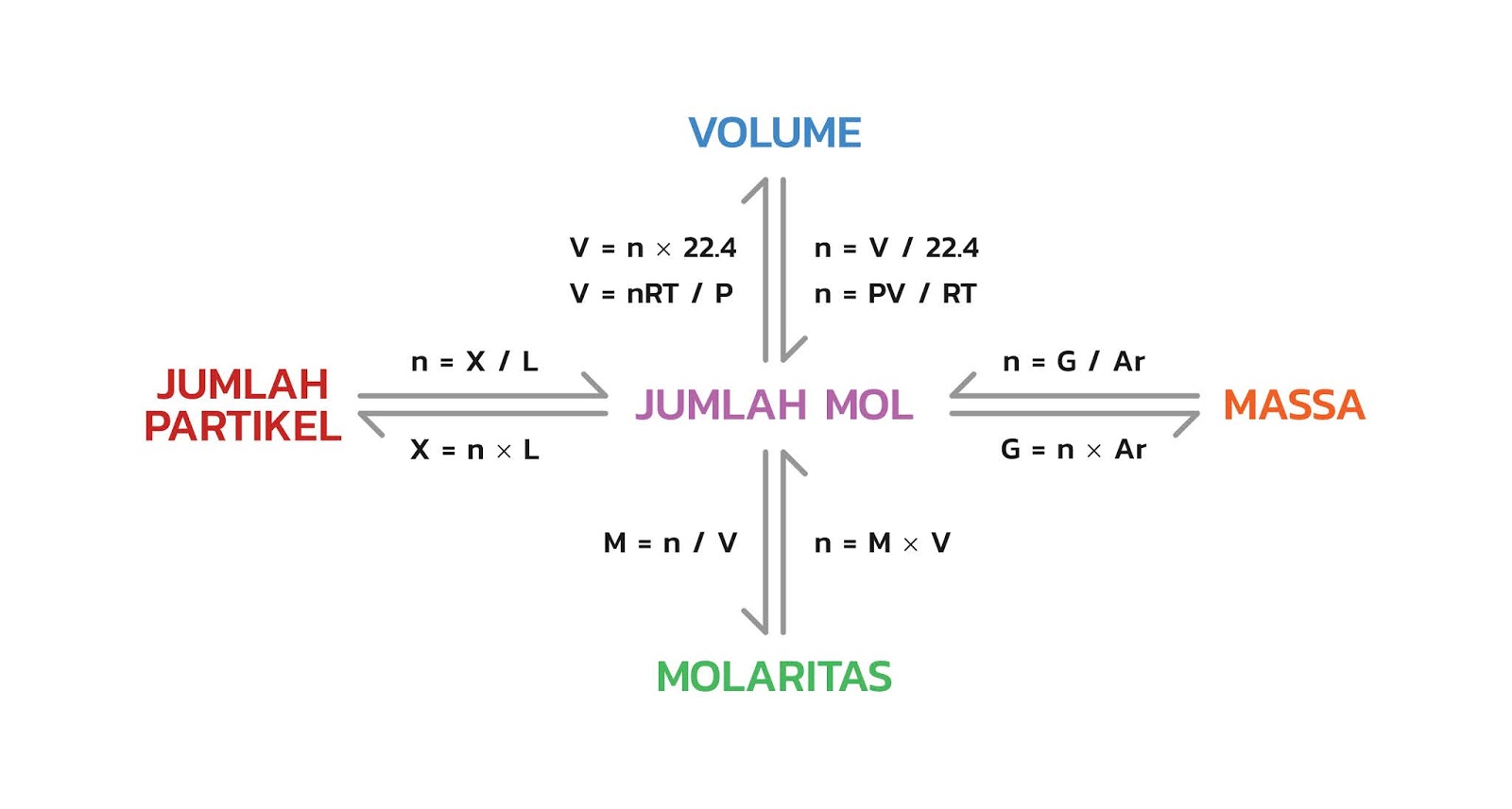
Selanjutnya kita coba bahas satusatu untuk setiap komponen.
STANDAR MOL setiap besaran pastinya mempunyai standar tertentu . Dan standar untuk 1 mol adalah 12 gram C-12 , karena mol didefinisikan sebagai sejumlah massa zat yang mengandung 12 gram C-12 . Melalui berbagai percobaan , para ahli menemukan jumlah partikel dalam satu mol adalah 6,0221421 × 10 23 . Konsep Mol - Volume. Hubungan konsep mol dengan besar volume dibahas dalam dua kondisi. Pertama adalah kondisi pada keadaan STP (Standard Temperature and Pressure) yaitu kondisi pada suhu 0° C dan tekanan 1 atm (atau 76 cmHg atau 760 mmHg). Sedangkan untuk kondisi kedua adalah persamaan untuk hubungan jumlah mol dan volume pada kondisi non - STP.




